自從西元1980年開始,科學家發現全球性兩棲動物族群數量有明顯下降的趨勢,超過6千種的兩棲動物中,發現約47%有數量減少的現象,約33%呈現瀕臨絕種。研究顯示,蛙壺菌(Batrachochytrium dendrobatidis)感染可能是主要元兇,拉丁美洲、歐洲及非洲許多國家皆陸續有病例發生。
目前資料顯示,此種疾病在野外難以遏阻,一個區域內具感受性的兩棲類受感染後,高達8成會在數月內死亡,嚴重感染會造成蛙類滅絕或絕種。有關蛙壺菌的致病機轉,目前仍不明。
蛙壺菌知多少!?
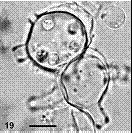
![蛙壺菌的生活史。圖片來源:參考文獻[2] 蛙壺菌的生活史。圖片來源:參考文獻[2]](http://e-info.org.tw/files/active/85/20080527-155403-image013.jpg)
|
Stage A |
從成熟的孢子囊釋放出孢子(zoospore),此時孢子有鞭毛(flagella)在水中37小時內具有運動性。 |
|
Stage B |
孢子附著在兩棲類動物皮膚表面,之後形成菌絲吸收宿主的體液與養分。 |
|
Stage C |
孢子細胞逐漸變大,細胞質內出現許多細胞核,細胞壁向外形成乳突樣突起。 |
|
Stage D |
此時孢子囊內可見許多孢子及明顯的排出管。 |
|
Stage E |
孢子囊內可見間隔(septa)形成,內含有數量不等的成熟孢子。 |
正常蛙類皮膚腺體具有分泌至少6種不同胺基酸,部分胺基酸(peptide)可以抵抗病毒、黴菌或細菌感染,是正常體表對外界的一種防禦機制。有文獻指出,在實驗室內,以活體外方式(in vitro)模擬蛙類皮膚腺體所分泌的不同胺基酸濃度,可以間接影響蛙壺菌的活性及致病性。
此結果或許間接說明不同品種蛙類的皮膚腺體因所分泌的抗菌胺基酸不同,導致對蛙壺菌感受性的不同,雖然胺基酸濃度的不同或許是一個因素,但野外暴發本病的真正原因及狀況,應無法完全以此單一因素來解釋。
蛙壺菌(B. dendrobatidis)可生存在水中、呈腐生或寄生在動植物體內,此真菌生長溫度範圍為4~25℃,最適合溫度為17-25℃,溫度高於28℃或低於10℃其生長即變緩或停止,生活史於22℃下約4到5天(參考文獻[2]),因此本病的發生應與溫度有相關性。
因物種差異導致感受性不同,所以發病率及死亡率均不同。此真菌主要寄生於兩棲動物的皮膚,進而影響皮膚的功能,包括滲透壓的維持、溫度的調節、呼吸、體液的維持及電解質的平衡;臨床症狀為衰弱、嗜眠、反應力下降、腹部膨大、體表顏色較為暗沉、姿勢異常、無法翻身、失去反射功能及偶見痙攣等。目前為止,尚未傳出蛙壺菌感染人類或其他動物的病例。
此真菌可藉由水的汙染、直接接觸污染物或動物,機械性傳播,並藉由輸出入而導致國際間的散播。目前已知的帶原者有蝌蚪、美國牛蛙(Rana catesbeiana)、非洲爪蛙(Xenopus laevis)、蔗蟾(Bufo marinus)及虎斑鈍口螈(Ambystoma tigrinum)。
肉眼病變為表皮粗糙或潮紅,伴隨沾粘灰白色腐脫之上皮,皮膚病灶區主要以腹部及後肢內側皮膚為主;組織病理學檢查,表皮呈現輕度到嚴重增生、糜爛到潰瘍,非角化上皮細胞呈現增生、變性及壞死,伴隨異嗜球、淋巴球及組織球浸潤。上皮可見大小約15-20 μm圓形或橢圓形孢子囊(sporangium),其表面偶可見排出管(discharge tubes),孢子囊內含有數量不一的孢子(spore);表皮角質層內常常可見內部不含孢子的殘存孢子囊;大小約7-15 μm的未成熟孢子囊則寄生於較深層的表皮細胞間或細胞質內,細胞內可見多個細胞核。
新近的文獻指出,此疾病的爆發必須考慮其他的協同因子,大部分學者認為全球暖化是最大主因(參考文獻[11]),其他因素包含棲地破壞、氣候變化、外來物種之間的競爭、環境汙染、紫外線(參考文獻[9])、季節及其他不明原因。兩棲動物中蛙類佔多數,牠們在食物鏈上扮演重要的獵捕者與獵物雙重角色,是全球食物鏈中的重要環節,成為水生動物與陸生動物間的連結,假如沒有兩棲動物,許多昆蟲的數量將無限制地增加,威脅公共衛生與食物供應,間接增加疾病散播。
國際防治與控制:「兩棲動物的諾亞方舟計畫」
2008年1月3日自由時報相關報導指出,蛙壺菌為全球性重要的議題,美國對此因應之道是進行的「兩棲類方舟計畫」,這項「兩棲動物保育行動計畫」預估耗資3千萬英鎊(合台幣19億元),規模之大,堪稱兩棲動物版的諾亞方舟。
最珍貴的物種將被移至動物園、水族館等機構的保護區,確保牠們的生存。計畫由隸屬世界自然保育聯盟物種生存委員會的「保育繁殖專家小組」、「兩棲動物專家小組」及世界動物園與水族館協會進行籌畫。
目前國外防治及控制方式有以下幾點:
(1)必須建立國內調查資訊,檢視是否野外、圈飼或寵物店有此病感染;
(2)減少輸入疫區兩棲動物;
(3)避免及控制病原擴散,針對疫區進入做管制,人員進出皆需要穿雨鞋、實驗衣及塑膠手套,若離開疫區器具需要消毒,接觸不同兩棲個體時,需更換拋棄式手套,廢棄物品ㄧ律消毒或高壓滅菌;
(4)推廣教育社會大眾,不買、不捕捉及不購買蛙類;
(5)避免移動不同區域的蛙類,包含卵、蝌蚪及成體;
(6)避免移動不同區域的水生植物、動物、土壤或其他物質,避免間接傳播;
(7)管理蛙類必須要有傳染病防護之操作觀念。
全球蛙壺菌感染 台大投入壺菌病研究
根據2005年國立成功大學侯平君教授等人發表台灣寵物店販售的外來種兩棲類,說明台灣西部都會區434家水族寵物店發現49種外來兩棲類,分屬14科31屬。其中美國牛蛙(Rana catesbeiana)及亞洲錦蛙(Kaloula pulchra)在台灣野外建立族群,此外海蟾蜍(Bufo marinus)、非洲爪蟾(Xenopus laevis)及綠箭毒蛙(Derdrobates auratus)則有入侵其他地區的紀錄,進口國家包含非洲、美國、東南亞、歐洲、大洋洲及太平洋群島。
回顧文獻,許多國家發皆已陸續發現有壺菌病的存在,分布地區主要在拉丁美洲、歐洲及非洲,但是亞洲除外。不過在2007年6月日本共同社報導,日本已首次確認國內神奈川縣野生牛蛙感染壺菌病。
全球性蛙壺菌感染是一項需要被關注的議題,有鑒於臺灣兩棲類寵物的進口皆來自疫區國家,而台灣與日本的地理位置接近且貿易頻繁,再加上台灣的緯度及氣候均適合蛙壺菌的生長,因此,台灣實有必要儘速針對壺菌病建立相關的診斷技術,希望藉由回溯性研究及持續性病例收集,探討台灣是否亦有本病的發生。
 |
 |
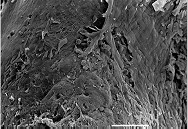 |
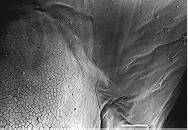
| 感染蛙壺菌的病蛙腹部與四肢呈現明顯皮屑增多及腹部皮膚潮紅 | 正常蛙類皮膚進行掃描式電子顯微鏡,表皮平滑,可見上皮細胞大小一致,Scale bar = 100 μm。圖片來源:參考文獻[2] | 感染蛙壺菌之病蛙皮膚進行掃描式電子顯微鏡,大量上皮細胞剝落,上皮細胞腫脹、變性或呈現破碎樣,可見上皮細胞大小一致,Scale bar = 100 μm。圖片來源:參考文獻[2] |
|
|
 |
 |
| 蛙壺菌孢子囊(sporangium)呈現圓形或椭原形,大小約15-20 μm,其表面偶可見排出管(discharge tube),孢子囊內含有數量不一的孢子(spore),Scale bar = 10 μm。圖片來源:參考文獻[2] | 此圖為蛙壺菌孢子囊進行掃描式電子顯微鏡,成熟的孢子囊(sporangium)會形成排出管,而排出管開口朝向皮膚表面,排出具有感染力的孢子,Scale bar = 10 μm。圖片來源:參考文獻[2] | 組織病理學檢查,表皮呈現輕度到嚴重增生及糜爛,非角化上皮細胞呈現增生、變性及壞死,伴隨異嗜球、淋巴球及組織球浸潤。上皮可見孢子囊(sporangium),偶可見排出管,孢子囊內含有數量不一的孢子(spore);表皮角質層內常常可見內部不含孢子的殘存孢子囊;大小約7-15 μm的未成熟孢子囊則寄生於較深層的表皮細胞,Scale bar = 15 μm。圖片來源:參考文獻[2] |
參考文獻:
1. Boyle DG, Boyle DB, Olsen V, Morgan JAT, Hyatt AD. Rapid quantitative detection of chytridiomycosis (Batrachochytrium dendrobatidis) in amphibian samples using real-time Taqman PCR assay. Dis Aquat Org, 60: 141-148, 2004.
2. Berger L, Hyatt AD, Speare R, Longcore JE. Life cycle stages of the amphibian chytrid Batrachochytrium dendrobatidis. Dis Aquat Org, 68: 51-63, 2005.
3. Bradley GA,1 Rosen PC, Sredl MJ, Jones TR and Longcore JE. Chytridiomycosis in Native Arizona Frogs. J Wildlife Dis, 38: 206–212, 2002.
4. Conlon MJ, Woodhams DC, Raza H, Coquet L, Leprince J, Jouenne T, Vaudry H. Peptides with differential cytolytic activity from skin secretions of the lemur leaf frog Hylomantis lemur (Hylidae: Phyllomedusinae). Toxicon, 50: 498–506, 2007.
5. Ells TV, Stanton J, Strieby A, Daszak P, Hyatt AD, Brown C. Use of immunohistochemistry to diagnose chytridiomycosis in dying poison dart frogs (Dendrobates tinctorius). J Wildlife Dis, 39: 742-745, 2003.
6. Goldberg TL, Readel AM, Lee MH. Chytrid fungus in frogs from an equatorial African mountain forest in Western Uganda. J Wildlife Dis, 43: 521-524, 2007.
7. Green DE, Converse KA, Schrader K. Epizootiology of sixty-four amphibian morbidity and mortality event in the USA, 1996-2001. Ann NY Acad Sci, 969: 323-39, 2002.
8. Hou PC, Shiau TW, Tu MC, Chen CC, Chen TY, Tsai YF and Wu SH. Exotic amphibian in the pet shops of Taiwan. Taiwan, 51(2): 87-92, 2006.
9. Johnson ML, Berger L, Philips L, Speare R. Fungicidal effects of chemical disinfectants, UV light, desiccation and heat on the amphibian chytrid Batrachochytrium dendrobatidis. Dis Aquat Org, 57: 255-260, 2003.
10. Nichols DK, Lamirande EW, Pessier AP, Longcore JE. Experimental transmission of cutaneous chytridiomycosis in dendrobatid frogs. J Wildlife Dis, 37: 1-11, 2001.
11. Pounds JA. Global warming and amphibian losses. Nature, 439: 161–167, 2006.
12. Kirshtein JD, Anderson CW, Wood JS, Longcore JE, Voytek MA. Quantitative PCR detection of Batrachochytrium dendrobatidis form sediments and water. Dis Aquat Org, 77: 11-15, 2007.
13. http://www.dpiw.tas.gov.au/inter.nsf/webpages/ljem-673v89?open#Howtopreventthesprea
※ 本文與農委會林務局合作刊登