 鐵溶於水中形成鐵離子,主要有二價鐵(亞鐵)及三價鐵,在不含有其他離子時,pH值中性且氧化環境(氧化還原電位Eh大於零)時,會形成氫氧化鐵沉澱,這也就是地表水(通常含有溶氧)不含鐵離子的主要原因(通常濃度小於0.3 mg/l)。
鐵溶於水中形成鐵離子,主要有二價鐵(亞鐵)及三價鐵,在不含有其他離子時,pH值中性且氧化環境(氧化還原電位Eh大於零)時,會形成氫氧化鐵沉澱,這也就是地表水(通常含有溶氧)不含鐵離子的主要原因(通常濃度小於0.3 mg/l)。
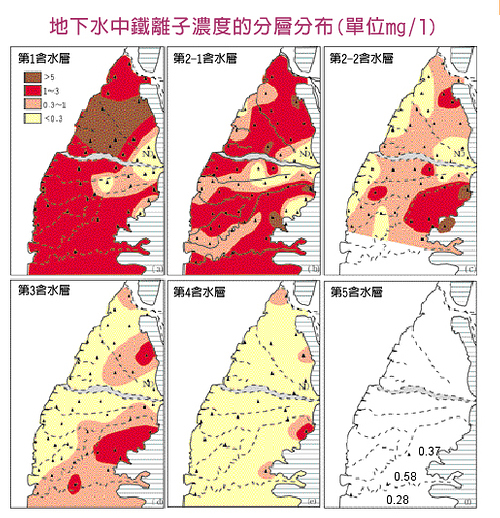
地面水開始流入地下後,就沒有氧氣的來源,加上地層中的生物殘餘所形成的有機碳,開始消耗溶氧,經過一段距離後,地下水中的溶氧就被「用」光了。以濁水溪沖積扇為例,扇頂區的地下水中還有溶氧,但往中下游流動,到扇央時溶氧就沒了,尤其泥層越多,溶氧消耗越快。
地下水缺氧後,地層中礦物裡的鐵質,經由微生物作用,就開始被還原出來,形成二價的亞鐵離子,此時控制厭氧(缺氧)水中鐵濃度的因子,主要為「碳酸氫根」及「硫化氫」離子。
淨化水質的重要功臣
 「硫化氫」是硫酸根離子被「硫酸根還原菌」(sulfate reducing bacteria: SRB)還原而形成。氣態的硫化氫(H2S)是有毒的,微量的硫化氫具腐蛋味,但高濃度反而無味,除了一氧化碳中毒的案例外,硫化氫害人的新聞也很常見,例如陽明山清洗溫泉槽的工人,或進入下水道作業工人遇害的消息。硫化氫對金屬的腐蝕性很強,常造成金屬管線腐蝕。在厭氧水中,硫化氫卻扮演「天使」的角色,因為離子態的硫化氫(例如HS-)與重金屬有強烈的結合能力,例如鉛、汞、銅、鋅、鎘、鉻等,形成硫化金屬沉澱,水中有害的金屬濃度因此降低。
「硫化氫」是硫酸根離子被「硫酸根還原菌」(sulfate reducing bacteria: SRB)還原而形成。氣態的硫化氫(H2S)是有毒的,微量的硫化氫具腐蛋味,但高濃度反而無味,除了一氧化碳中毒的案例外,硫化氫害人的新聞也很常見,例如陽明山清洗溫泉槽的工人,或進入下水道作業工人遇害的消息。硫化氫對金屬的腐蝕性很強,常造成金屬管線腐蝕。在厭氧水中,硫化氫卻扮演「天使」的角色,因為離子態的硫化氫(例如HS-)與重金屬有強烈的結合能力,例如鉛、汞、銅、鋅、鎘、鉻等,形成硫化金屬沉澱,水中有害的金屬濃度因此降低。
在濁水溪沖積扇第1含水層中,扇頂地下水的鐵濃度很低,因為有溶氧,使鐵離子變成氫氧化鐵沉澱。離開了扇頂區,鐵濃度越往深層越低,硫化氫碰到鐵變成硫化鐵沉澱。初生成的硫化鐵是無晶形,墨黑色,數小時後漸變為Mackinawite礦物,也還不穩定,最後會轉變成黃鐵礦(pyrite:Fe2S),也就是俗稱的「愚人金」。從無晶形到黃鐵礦,地下水中的鐵濃度降低數百至千倍以上,其他的重金屬也會共沉澱在黃鐵礦附近,包括砷也會形成硫砷鐵礦,水質因此被「淨化」了。
※本文圖文資料摘錄自遠足文化《台灣的地下水》






